國衛院發現抑制癌細胞糖酵解新藥 登美國期刊封面

國家衛生研究院今天(5日)發布消息,國衛院生技與藥物研究所發現了可促進腫瘤內的MYC癌症驅動蛋白質降解,抑制腫瘤進行糖酵解作用,使癌細胞死亡的藥物。此項發現是癌症治療上的重大進展,研究成果今年更被選為美國癌症研究協會出版的知名學術期刊《Molecular Cancer Therapeutics》當期封面文章。
國衛院說明,癌症是細胞基因受到改變而不斷增生的結果,致癌基因(oncogene)就是可將正常細胞轉換成癌細胞的基因變異,變異的成因為基因突變或是基因擴增。目前市面上許多標靶治療的藥物,例如治療慢性骨髓性白血病的「基利克」(Glivec)及治療肺腺癌的藥物「艾瑞莎」(Iressa)等,皆是針對癌細胞特殊的基因變異所研發的。然而,有許多致癌基因及其所產生的癌症驅動蛋白質雖在臨床、學術研究上發現多年,卻受制於蛋白質本身的特性問題難以成藥,致癌基因MYC就是一例。
高達28%的常見癌症均帶有MYC致癌基因擴增,如肺癌、肝癌、乳癌及淋巴癌等。癌細胞為了能夠大量複製生長,利用糖酵解作用獲得較一般細胞生長所需更多的能量與原料,而MYC蛋白質的功能就是作為轉錄因子,協助轉錄生成許多細胞進行糖酵解作用所需要的酵素,因此在癌細胞中常發現帶有MYC基因擴增或過表現的變異,促使癌細胞快速生長,術後復發率也高,使病患的整體存活率下降。雖然MYC蛋白質對於癌症發生以及維持的重要性相當明確,但是因為其蛋白質結構至今仍無法解出,因此很難針對此蛋白質的結構設計小分子化合物來抑制其功能。
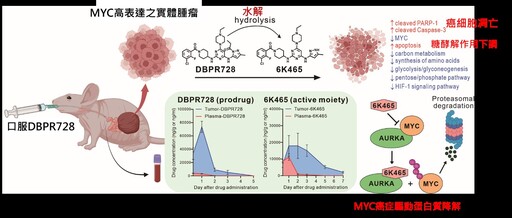
生藥所研究員紀雅惠、陳炯東及副研究員葉燈光與張竣評博士合作,利用極光激酶A穩定MYC蛋白質的特性,設計小分子化合物破壞兩個蛋白質之間的結合力,造成MYC蛋白質可以被帶入細胞的蛋白酶體進行降解。過去雖然有其他小分子化合物也可以利用類似機制促使MYC蛋白質降解,但因在腫瘤的代謝速度快且生體利用率低,無法在腫瘤內造成有效的MYC蛋白質降解。
國衛院的候選發展藥物DBPR728因特殊的前體藥物(prodrug)設計,從口服途徑經過腸胃道到達腫瘤的藥物濃度本身就比其他類似小分子高出許多,並且可以在腫瘤逐漸釋放出活性藥物,維持在腫瘤的有效濃度以及生體利用率,促使腫瘤消退。在多種具MYC基因擴增或高表達的異種移植腫瘤小鼠動物模式,如小細胞肺癌、三陰性乳癌、肝癌、髓母細胞瘤等,皆證實可以造成腫瘤消退,部分異種移植腫瘤在停藥後3個月內甚至未發現復發跡象。
此技術已獲得中華民國專利,目前正著手布局全球專利。期望未來能與生技公司完成技術移轉,完成臨床前毒理試驗以及進入臨床試驗,為癌症精準醫療標靶藥物增添另一項治療利器。
- 記者:愛傳媒
- 更多生活新聞 »


