張金堅:從諾貝爾生醫獎談微型RNA的醫療應用

本文摘自<常春月刊>501期
文/張金堅
今年諾貝爾生理醫學獎頒給麻州大學醫學院教授,也是發育生物學家維克托.安布羅斯(Victor Ambros)和哈佛醫學院教授,也是分子生物學家加里.魯夫昆(Gary Ruvkun),表揚他們發現微型核醣核酸(miRNA)及其調控基因表現的機制,改變了我們過往對基因調控及致病機轉的認識,對於人類的胚胎發育、調控各種生理功能,甚至引起各類疾病,都有密切的關係。微型核醣核酸有望成為未來治療疾病的標靶或當做疾病診斷的標記,將是醫療上的重大突破。
本文擬將有關微型核醣核酸的發現緣由、構造、功能,乃至醫學上的應用,做一綜合性的探討與闡述,並與讀者分享。
微型核醣核酸的發現緣由
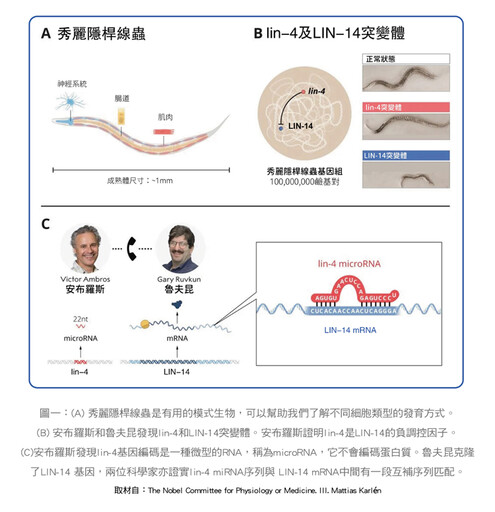
微型核醣核酸(miRNA)的發現並不是一片坦途。在西元1993年,安布羅斯(Victor Ambros)及魯夫昆(Gary Ruvkun)分別領導的兩個實驗室,在「秀麗隱桿線蟲」(C. elegans)發現了一個名為lin-4的基因,這種基因不會編碼蛋白,而是一種長度為22nt(nucleotide核苷酸)的小RNA,而這種小RNA可以抑制一種核蛋白LIN-14基因的表達,從而調節線蟲的發育。
他們認為這種抑制機制在於lin-4會與LIN-14 mRNA(信使核醣核酸)的3'-UTR上獨特的重複區域互補,但當時這項發現未被重視。
直到2000年,魯夫昆在線蟲的研究發現第二個miRNA命名let-7,長21nt,與lin-4相似,let-7也能透過結合在一些目標基因(LIN-14、LIN-28、LIN-41、LIN-42以及DAF-12)的mRNA的3'-UTR上,進而調控線蟲的發育。然後才發現成千上萬的miRNA存在各種物種(包括人類在內的動、植物)中,有關miRNA的迅速發展及廣泛研究受到學術界的重視,開始了突破性的醫療應用。(圖一)
微型核醣核酸(miRNA)的構造、生物合成
miRNA是microRNA的簡稱,是在5'端磷酸基團、3'端帶羥基,長度為19到25個核苷酸(nucleotide, nt)的非編碼調控RNA家族。到目前為止,運用多種實驗方法及生物資訊學方法,已經找到了上千種miRNA,人類大概有1000至2000個miRNA,甚至更多。miRNA是長度很短的單鏈RNA,其大小是一根頭髮直徑縮小約100萬倍,約7奈米,超迷你的。
誠如上述,一開始是使用「秀麗隱桿線蟲」作為模式生物,由於這種線蟲長約1釐米,是透明的,容易觀察,構造也相對單純,有固定的細胞數量及發育過程,且壽命只有二至三週,很適合做為發育生物學、老化生物學相關的研究對象。miRNA是一類在演化上非常保守的基因,而線蟲有55%的miRNA與人體內有同源分子,暗示miRNA在演化上高度保守,可能具有重要的生物學功能。
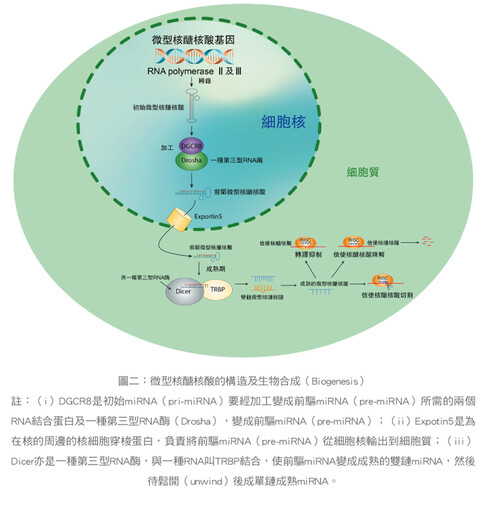
miRNA在基因組上的位置分佈非常廣泛,既可在非編碼單元,亦可在編碼單元,至於其合成過程有下述五個步驟:
①miRNA的轉錄(transcription)由RNA polymeraseⅡ,中文叫RNA聚合酶Ⅱ佔大多數,及RNA polymeraseⅢ(佔少數)來介導;
②轉錄形成初始轉錄物(pri-miRNA,又叫初始微型RNA),一般長達數千nucleotide(nt, 核苷酸),內部有莖環結構;
③pri-miRNA(初始微小RNA到成熟體miRNA,要經歷「切兩刀」:「第一刀」是共轉錄過程,pri-miRNA上的莖環結構會在細胞核中被RNaseⅢ型的核酸內切酶Drosha從初始微小RNA上切下來,得到的是長約65nt(nucleotide核苷酸)的小髮夾結構(hairpin),叫做前驅miRNA(pre-miRNA);
④「第二刀」:pre-miRNA被一種轉運蛋白叫exportin-5(EXP5),由細胞核轉運到細胞質,被另一種核酸內切酶Dicer切第二刀,形成一個22nt(nucleotide核苷酸)左右的雙鏈miRNA(miRNA-miRNA duplex),然後鬆開成單鏈成熟體的單鏈miRNA;
⑤Drosha酶和Dicer酶的切割會在切口的3'端留下2個nt的懸垂結構(overhang),這一結構使得miRNA被裝載到RISC(RNA-induced silencing complex,RNA誘導沉默複合體)上。(圖二)
miRNA(微型RNA)的作用機制及生物功能
當miRNA被裝載到RISC(RNA-induced silencing complex,RNA誘導沉默複合體),便可以發揮其基因表現及調控作用。miRNA會透過其種子序列(5'端第2至第8個核苷酸),與信使核醣核酸(mRNA)的識別目標基因mRNA 3'-UTR上的結合位點上結合,攜帶RISC,發揮其作用,而主要作用有三種:(i)轉譯抑制(Translational repression);(ii)mRNA(信使核醣核酸)的切割(mRNA cleavage);(iii)mRNA的降解(mRNA degradation)。
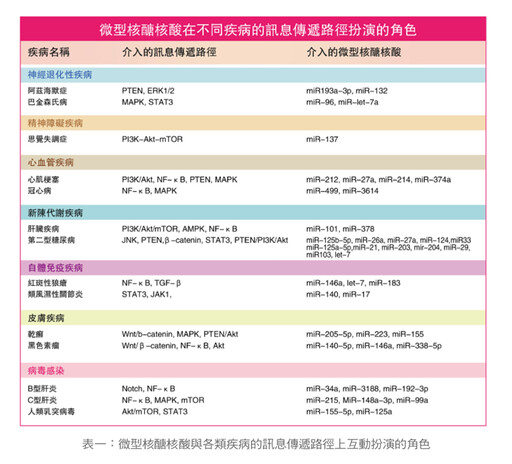
至於miRNA的生物功能涉及生物本身發育、抵抗病毒入侵、心臟血管、神經系統功能、免疫功能,乃至新陳代謝方面(如糖尿病),甚至與癌症進展有關。其包括的範圍幾乎遍及身體各組織器官,miRNA會與各器官或組織的細胞內之訊息傳遞路徑(signal pathway)互動。
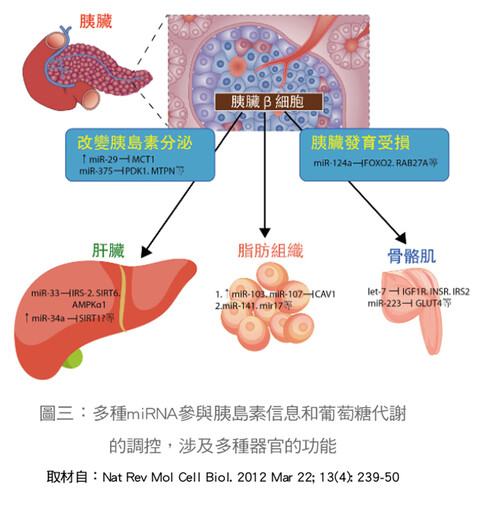
誠如上述,在人類miRNA有一千個至二千個,甚至更多,會與細胞內九大重要訊息傳遞路徑互相溝通,互為影響。如果運作不正常的話,則所牽連miRNA有增減或變化,造成不同的疾病。為了便捷起見,以表一做簡要說明,其中miRNA在新陳代謝方面的功能,本文以糖尿病為例作較詳細闡述。miRNA也參與脂肪細胞的生成及功能調節,如miR-143可使脂肪前驅細胞化成成熟脂肪細胞,miR-204及miR-141則參與早期脂肪細胞的發育,miR-17則與維持成熟細胞的功能有關,其他還有對肝臟、胰臟及骨骼肌亦有影響,詳如(圖三)。
另一值得一提的是miRNA的調控不只侷限在細胞內,根據多項研究證實,在血清中存在大量miRNA,是構成血清中循環核酸的主要部份。此外亦有研究發現在乳癌、肺癌、大腸直腸癌、前列腺癌,甚至第Ⅱ型糖尿病患者和正常人血清中miRNA的表達譜不盡相同;特別發現各類癌症患者血清中有不同miRNA的表現,稱為「循環miRNA(circulating miRNA)」,利用這些特有的miRNA可做為疾病的檢測,也算是一種生物標記(Biomarker)。
這些循環miRNA來自①破裂的細胞或受損的組織被動釋放、②經由外泌體(exosome)主動分泌、③不被外泌體包裹,而是與RNA結合蛋白(RNA-binding protein, RBP)結合分泌。
其中以外泌體主動分泌最重要,其所分泌的循環miRNA可以作為細胞與細胞間的通訊方式,攜帶重要訊息在不同細胞、組織與器官之間,傳遞並發揮調節功能(cross-cell, tissue or organ regulation),甚至可以穿過胎盤調節子代的發育(cross generation regulation)。
微型RNA在癌症診斷、治療及預後扮演的角色
西元1993年在線蟲發現第一微型RNA(lin-4)以後,直到2000年才由Reinhart BJ等人,在人類發現第一個微型RNA叫let-7。而第一個發現微型RNA與癌症有關的證據,是來自慢性淋巴球性白血病(Chronic lymphocytic leukemia, CLL)的研究,Calin GA等人在2002年發現七成CLL病人在第13號染色體q14的位置,有miR-15a與miR-16-1基因表達異常現象。
在2004年Takamizawa發現人類肺癌其let-7 miRNA表現少的病人有較差的預後,而後相繼有學者發現,有些微型RNA早在臨床症狀出現以前,就出現在血液中,故可當做早期癌症診斷的生物標記。
miR-21及miR-205在早期膽管癌的患者血液中可偵測出來。乳癌miR-200在管腔組織中表達,而miR-145及miR-205則在乳腺上皮細胞表達,藉此可以用來做乳癌腫瘤組織的病理分型。
2015年台大基因體醫學中心莊曜宇教授與本人,利用24位三陰性乳癌檢體以及14位乳癌周圍正常組織檢體,從中取得微型RNA之表現圖譜,並進行生物資訊分析,在707個微型RNA中,找到25個在三陰性乳癌檢體與周圍正常組織間具有顯著表現差異的微型RNA,並利用主成份分析與階層化叢集分析,確認了它們分別癌症與正常組織的表現不同(圖四)。在此25個微型RNA中,我們研究團隊利用螢光素酶檢測法分析,證實了hsa-miR-1306-5P對CCNG2基因的負向調節能力,此CCNG2基因是細胞週期的重要調節基因,並證實與癌細胞增生有關。
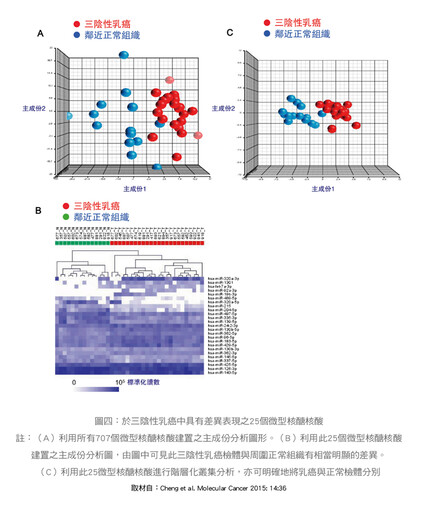
這個結果顯示hsa-miR-1306-5P藉由調控CCNG2,進而影響三陰性乳癌細胞的細胞周期調控,進而促進乳癌細胞增生,此研究發表於《Molecular Cancer》之國際知名期刊。此次重要結果可以讓我們了解三陰性乳癌之致癌機轉,進一步可能找到治療新藥。
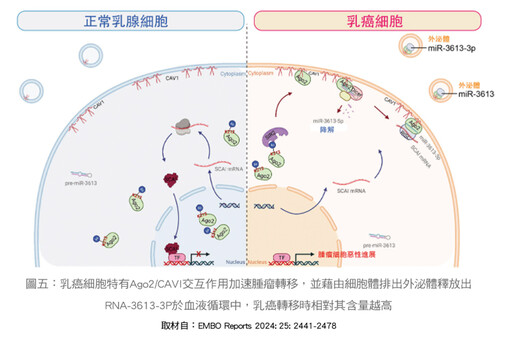
另外,在過去有諸多研究中進行Ago2在許多腫瘤中有過度表現的現象,國家衛生院李華容博士及台大醫院郭文宏醫師合作的研究團隊發現乳癌細胞膜上的CAVI會與Ago2結合,而乳癌細胞特有的Ago2/CAVI之交互作用,進而促進腫瘤透過外泌體釋放特定的miRNA-3613-3P,此釋放特定的miRNA,在乳癌轉移患者血液中的濃度遠高於無轉移的患者。此等研究證實外泌體的miRNA可以作為疾病生物標記,對於未來癌轉移偵測及治療將有相當大的助益,本研究成果亦已於2024年發表在國際知名學術期刊《EMBO reports》。(如圖五)
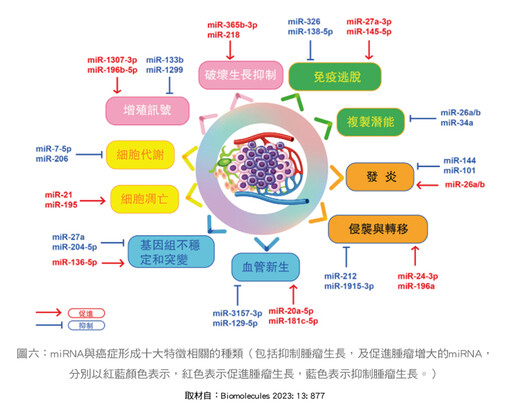
在2022年,瑞士科學家道格拉斯.漢娜(Douglas Hanahan)在知名醫學期刊《Cancer Discovery》發表一篇綜述,在文中共列舉「癌症的特徵(Hallmark of cancer)」,有十四大項。更重要的是,根據2023年Yang等人在《Biomolecules》的綜述中,特別強調miRNA在十四項癌症特徵之中,其中有十項與miRNA有關,這些miRNA有的是促進癌腫瘤變大,更具侵襲性,而另外有些miRNA則具有抑制腫瘤變大的功能,其促進或抑制的功能詳述如(圖六)。
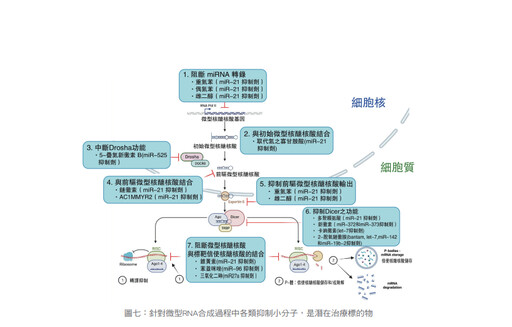
至於miRNA如何成為各種癌症治療的標的物,其實miRNA作為治療目標的執行策略有二,一種是直接將特定寡核苷酸(oligonucleotide)序列片段送進細胞內,以抑制致癌性(oncogenic)微型RNA或增加細胞內抑癌性(tumor supressor)微型RNA的量;另一種是間接地以藥物來改變細胞內微型RNA的量或型態,進而達到抑制腫瘤生長的效果。根據布朗大學Seyhan AA等人綜合整理從細胞核中miRNA的基因經由初始miRNA至成熟miRNA之間有很多步驟,在各步驟有特定小分子可以加以阻斷或終止以達到治療效果。(如圖七)
此外,特定微型RNA的出現,可作為癌症化療與標靶藥物治療效果的指標。例如,miR-21的過度表達是化療治療效果不佳的預測指標。而miR-221與miR-222過量表達,則與標靶藥物泰莫西芬(Tamoxifen)的抗藥性有關。近年來,數種微型RNA的表達被發現與癌症的藥物治療效果有關。偵測微型RNA的異常表達狀況,更能反應出癌症的預後狀況。例如miR-155的過度表現合併let-7a的過低表現與肺癌的預後不佳有關,而miR-193a的過度表現合併miR-191的過低表現,則與胃癌的存活率不佳有關。
此外,研究發現若肝癌(hepatocellular carcinoma, HCC)患者血液中的miR-26表現量低,則這類肝癌患者對於干擾素(interferon-α)治療的反應較佳;乳癌患者之miR-125b表現量高,則與其對紫杉醇(Paclitaxel)藥物反應不佳有關。
miRNA在醫療上面對的挑戰與困境
miRNA在醫療上的應用,從診斷方面的生物標記、針對各類疾病特定標的治療新藥研發,乃至預後指標,都有很大的潛力。然而miRNA的藥物應用仍面臨諸多挑戰,因為我們尚未完全理解每一個miRNA會結合哪些目標基因,所以難以全面性的了解其功能,也難以評估藥物的副作用。
此外,因為與miRNA相關的研究很多,不同的研究水準和使用的技術差異大,還需要更多實驗去驗證miRNA用於診斷疾病的精準度如何?可靠性如何?都還需要深入探討。
miRNA影響的蛋白質功能過於廣泛,會影響太多不是治療目標的蛋白質功能,無法精準瞄準導致發生「脫靶效應(off-target effects)」,嚴重的話,恐造成不可逆的基因突變。還有,miRNA容易累積在肝臟中,較難被運送至目標器官或組織,更嚴重的是這些研發的新藥會引發很多預期不到的副作用,甚至有危及生命的毒性。像過去即有治療肝癌的MRX34,以及治療C型肝炎的RG-101,在研究過程中雖展現很好的療效,但同時出現不少嚴重副作用而停止研發。
至於這些藥物在人體體內的穩定性、遞送系統的效率、藥物的清除速率,如何精準辨識潛在而且重要的標靶mRNA,還有miRNA間相互調控作用的結果如何?這些都亟待將來解決,更重要的是擺在當前的重大議題,就是如何找齊所有miRNA和找到它們的標靶基因,並揭示它們的功能。
結語
在1990年前,科學家認為生命科學的中心法則,是去氧核醣核酸(DNA)轉錄出核醣核酸(RNA),再製作出蛋白質,由蛋白質去調控細胞中其他蛋白質的功能。這次得獎的微型核醣核酸,跟以往認知的中心法則不同。自從1993年,安布羅斯及魯昆夫在線蟲發現第一個miRNA後,才知道miRNA可以在產生RNA的過程中,調整每個細胞中不同的蛋白質產量,是調控各種物種(包括人類在內的動植物)生長發育過程中扮演重要的角色。
另外,miRNA在各類疾病(包括神經退化性疾病、心血管疾病、自體免疫疾病、新陳代謝疾病,乃至癌症),其在訊息傳遞路徑上都與miRNA有關。眾所周知,微型RNA僅有19至25個核苷酸長度,相對於長序列的信使RNA而言,具有較高穩定性,可在多種檢體如血液、血清、血漿、外泌體(exosome)、唾液、尿液,甚至糞便中,偵測到微小RNA的存在,因此適合拿來作為生物標記(biomarker)。
總之,miRNA廣泛存在於人類的不同細胞中,也可排出存於體液中,多項研究證實對於各類疾病(包括癌症在內)的發生與進展有關,可以發展出有用的生物標記,在各類疾病的檢測、預後與疾病監測必有廣泛的應用。特別在癌症的研發方面,已有目標miRNA模擬物和抑制物的開發,目前因人類miRNA多達2千種以上,加上其與mRNA之間的關係相當複雜。
未來人工智能(AI)的技術有望協助處理大量的微型RNA研究數據,如基因體學、轉錄體學、蛋白體學、表觀基因體學、代謝體學等多體學(Multiomics),提供個人化精準醫療的發展,在診斷方面更精確,在治療方面療效極大化,副作用極少化,這些進展將來必然可以實現。
(圖片來源:Dreamstime/典匠影像)
延伸閱讀:
.張金堅:次世代基因定序是萬能的嗎?
.張金堅:從精準醫療到元宇宙健康照護
- 記者:常春月刊
- 更多健康新聞 »


